维持血糖稳态的生理意义
正常生理状态时,人体血糖水平稳定在3.9~5.6 mmol/L(稳态平衡),以确保大脑、红细胞等依赖葡萄糖供能的细胞的正常生理功能,这种状态称之为血糖稳态(Glucose Homeostasis)。
“稳态(Homeostasis)”这一生理学重要概念,最早于1926年被美国生理学家坎农(Walter B. Cannon)提出,揭示了生命活动的正常进行有赖于内环境相对稳定的内在规律。重在强调:稳态不是静态的;相反,它是一个动态的自我调节系统,涉及到各个系统、器官的协调工作,能够在面对不断变化的环境需求时保持生存能力。
维持血糖稳态的生理意义
葡萄糖是人体细胞赖以生存的主要能量来源:经胃肠道摄取的葡萄糖由3类主要组织进行使用和储备,其中将近三分之一的葡萄糖被大脑和血红细胞等器官组织无条件使用,用以维护人体的核心生理功能,其余三分之二的葡萄糖的使用受胰岛素的调控,在肝脏、肌肉和脂肪系统中进行储备和使用,其中肝脏摄取了一半的葡萄糖。
维持血糖稳态的生理意义是保证机体各重要脏器正常运转的基础:大脑依赖葡萄糖作为能量来源,葡萄糖不足或低血糖会导致大脑功能障碍、意识丧失,严重者甚至死亡。相反,持续的高血糖或糖尿病,会引起广泛的代谢紊乱,损害全身重要组织器官。如果不加以控制,就会出现心血管疾病、失明和肾功能衰竭等并发症。
血糖稳态调控及其调控器官功能
血糖水平相对恒定是由于血糖的来源与去路保持动态平衡所致。餐后血糖来自食物消化吸收,此时所有去路均活跃进行;短期饥饿时,血糖来自肝糖原分解,仅用于满足基本供能需求;长期饥饿时,血糖来自非糖物质的糖异生,此时除少数对葡萄糖极为依赖的组织仍用糖供能外,其他大多数组织改用脂质能源以节约葡萄糖。因此,恒定的血糖水平是糖、脂肪、 氨基酸代谢相协调的结果,也是肝、肌、脂肪组织等各器官组织代谢相协调的结果。
葡萄糖稳态调控系统如同精密的温度调控系统,需要核心调糖靶器官(胰岛、肝脏、肠道等)精密协作、共同发挥作用以维持整个血糖稳态的平衡。在这个生理性稳态调控系统中,葡萄糖激酶(GK)作为传感器发挥着核心作用:敏锐感受葡萄糖浓度变化,启动参与血糖调节系统的不同类型细胞(β细胞、α细胞、肠道L细胞等)释放控糖激素(胰岛素、胰高糖素、GLP-1等),并作用于肝脏促进肝糖元的合成或分解,使葡萄糖浓度始终维持在稳态范围内。
人体血糖稳态平衡调控的感应和执行系统
大脑在血糖平衡系统中,既是能量的主要消耗者,也是能量变化感应器官,调节着人体的进食规律。人体血糖的平衡调节主要依赖于控糖激素(胰岛素和胰高血糖素)的及时分泌和作用。人体应对空腹和餐后血糖的变化,产生控糖激素来及时有效地调控血糖平衡,主要依赖于在胰岛和肠道相关细胞中存在的血糖感应器分子——GK的生理功能。在葡萄糖摄取之后,胰岛β细胞感应到血糖浓度高于5 mmol·L-1后,GK被激活,启动胰岛素分泌,同时肠道也因血糖升高而分泌GLP-1,并通过激活在β细胞上的受体,刺激胰岛素的释放;肝脏的GK在血糖升至10 mmol·L-1 后被激活,启动肝糖原合成;当血糖降低到4 mmol·L-1 以下时,GK活性迅速下降,启动胰岛α细胞的胰高血糖素释放机制,胰高血糖素作用于肝细胞的受体,启动肝糖原分解和糖异生机制,机体输送葡萄糖,维持血糖平衡。
(人体血糖稳态平衡调控的感应和执行系统)
从机体稳态系统的视角看待糖尿病
稳态系统自主调节失常导致血糖失稳态是T2DM发病的基础。GK的正常功能是稳态系统自主调节的关键,GK功能受损会导致核心调糖靶器官部分能力的缺失,甚至对血糖变化“视而不见”,从而产生胰岛素和胰高糖素分泌失常、葡萄糖利用能力降低、肝糖原合成受阻等糖代谢紊乱,表现为血糖稳态的严重失衡,包括HbA1c不达标、餐后血糖不达标、血糖波动大、低血糖频发等。
由于2型糖尿病患者的GK表达下降、活性降低,造成了核心调糖靶器官的调控能力缺失,进一步导致稳态系统失常,血糖失稳态。针对GK活性进行调节,提高和改善其功能以重塑血糖稳态,已成为2型糖尿病新药研发的方向之一。
葡萄糖激酶(glucokinase,GK)又称己糖激酶(hexokinase,HK)‐Ⅳ,属于HK家族的一种亚型。HK家族在人体中的亚型还包括HK‐Ⅰ、HK‐Ⅱ及HK‐Ⅲ,HK在细胞内葡萄糖摄取和利用过程中发挥重要作用,不仅启动葡萄糖利用的所有主要途径,并可维持促进葡萄糖进入细胞所需的梯度浓度,从而影响细胞内葡萄糖通量的大小和方向。在不同细胞中,不同HK亚型的结构和分布不一,其功能及其调控存在很大差异,其中,GK独特的分子结构及酶动力学特征,使其成为人体内唯一可以作为葡萄糖传感器的HK。
GK主要存在于肝脏和胰腺中,其中99.9%位于肝脏。此外,在肠道内分泌细胞(包括L细胞和K细胞)、下丘脑和脑干的多个部位,垂体前叶细胞7中也发现有GK表达。
生物学特性
晶体结构:GK晶体分为大区域和小区域, 大小区域之间通过连接区域连接,两区域间存在一个能与底物结合的可变角。在人体内GK存在三种构象,当葡萄糖浓度较低时,GK处于非活性超开放构象;当体内葡萄糖浓度升高时,GK与葡萄糖结合,处于活性开放/闭合构象。
(GK晶体结构)
作为单体变构酶,GK在糖代谢中存在三种构象和两种催化循环。当葡萄糖浓度较低时,GK处于非活性超开放构象(可变角为100°),糖代谢进入“慢循环”;当体内葡萄糖浓度升高时,GK与葡萄糖结合,处于活性开放/活性闭合构象(可变角分别为65°和40°),糖代谢进入“快循环”。
(GK与葡萄糖结合的变构)
酶动力学特征和催化功能:GK作为独特的单体变构酶,与葡萄糖结合后,酶的构象发生改变,新构象有利于后续葡萄糖与酶结合及酶亲和度的提高,希尔系数为1.7(希尔系数>1为正协同,即一个葡萄糖分子与GK结合,GK对其他葡萄糖分子亲和度增加),因而出现同促正协同作用,葡萄糖动力学曲线为“S”型,底物葡萄糖浓度较低时,酶活性增长缓慢,葡萄糖浓度升高到一定程度后,酶活性显著增加,最终增至最大活性。从GK的动力学曲线可以看到,葡萄糖拐点浓度约为3.5 mmol/L,S0.5(1/2 Vmax时的底物浓度,反映了酶和底物的亲和力大小)约为7.5 mmol/L,与正常血浆葡萄糖浓度相当,因此保证了在生理葡萄糖水平下的最佳响应性,即当葡萄糖浓度发生微小变化时,GK仍可控制反应速率,发挥葡萄糖传感器的作用。在胰岛细胞内,GK可催化葡萄糖磷酸化为G6P,导致ATP‐K+通道关闭,诱导膜电位去极化,激活Ca2+通道,促进胰岛素释放;在肝细胞内,促进肝糖原合成,储存能量。GK活性不受反应物G6P的反馈抑制机制调节。
(GK动力学曲线)
表达调节:人体GK基因位于第7号染色体短臂,存在两个启动子,分别是:①上游神经内分泌启动子,驱动胰腺、大脑、垂体和肠道内分泌细胞中GK的表达;②下游肝启动子,控制肝脏中GK的表达。在胰岛细胞中,GK的表达主要依赖于葡萄糖。葡萄糖对GK的影响主要发生在GK转录后,葡萄糖浓度升高可使细胞内GK蛋白表达增加。在肝脏中,GK 的表达严格依赖于胰岛素。
GK的作用机制
血糖稳态是机体通过精密的调控系统,将血糖维持在一个狭窄的范围之内。血糖稳态调控系统如同精密的温度调控系统,需要核心调糖靶器官(胰岛、肝脏、肠道等)精密协作、共同发挥作用以维持整个血糖稳态的平衡。在这个生理性稳态调控系统中,GK作为传感器发挥着核心作用:敏锐感受葡萄糖浓度变化,启动参与血糖调节系统的不同类型细胞(β细胞、α细胞、肠道L细胞等)释放控糖激素(胰岛素、胰高糖素、GLP-1等),并作用于肝脏促进肝糖元的合成或分解,使葡萄糖浓度始终维持在稳态范围内。
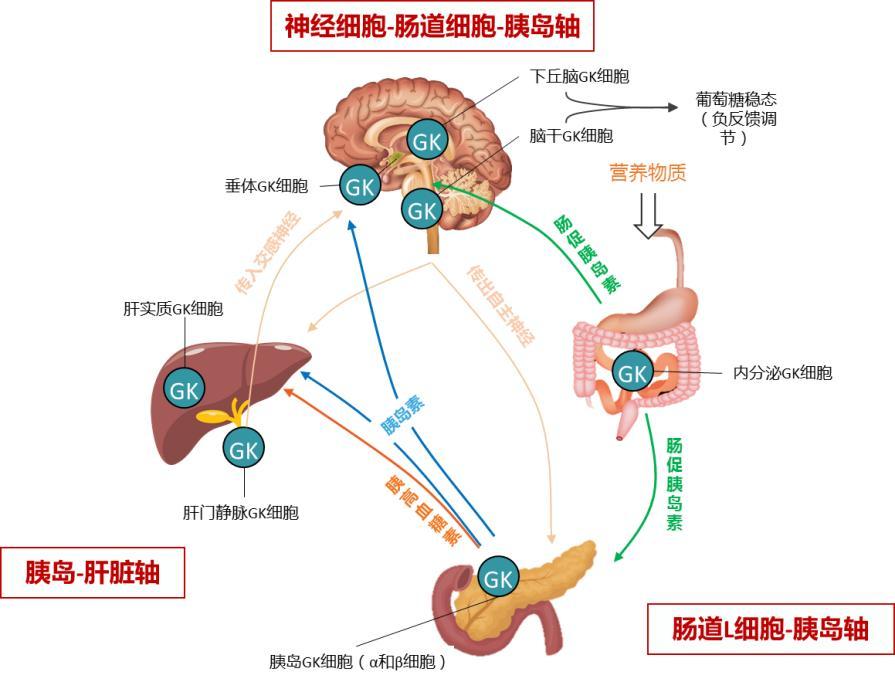
GK参与机体血糖稳态调控的细胞、器官和系统形成了基本的三大轴:胰岛-肝脏轴;肠道L细胞-胰岛轴;神经细胞-肠道细胞-胰岛轴。GK将这主要的三大轴又相互连接成一个高度网络化系统,调控血糖稳态。
(GK参与机体血糖稳态调控的细胞、器官和系统形成了基本的三大轴)
胰岛-肝脏轴
胰腺(β/α细胞)和肝脏通过GK形成血糖稳态调控回路:在葡萄糖摄取之后,胰岛β细胞感应到血糖浓度高于5 mmol/L后,GK被激活,启动胰岛素分泌;逐渐升高的胰岛素作用于肝脏细胞,促进肝细胞GK的基因表达,为其发挥作用提高足够量的GK。当血糖浓度升至8 mmol/L时,GK与葡萄糖调控蛋白解离,前者在肝细胞质中恢复酶的活性,启动肝糖原合成。肝脏GK的基因表达依赖于胰岛素,而GK在胰腺的促胰岛素释放作用与此形成调控回路。当血糖降低到4 mmol/L以下时,GK活性迅速下降,启动胰岛α细胞的胰高糖素释放机制,胰高糖素作用于肝细胞的受体,启动肝糖原分解和糖异生机制,为机体输送葡萄糖,维持血糖稳态。通过GK的作用,机体最为重要的葡萄糖感知细胞和葡萄糖处置细胞相互协调,维持血糖稳态。
肝细胞中存在的GK有两个特点,一是对葡萄糖的亲和力很低,二是受激素调控。它对葡糖-6磷酸的反馈抑制并不敏感,这些特性使葡糖激酶对于肝维持血糖稳定至关重要,只有当血糖显著升高时,肝才会加快对葡萄糖的利用,起到缓冲血糖水平的调节作用。
肠道L细胞-胰岛轴
GK调控肠道L细胞胰高糖素样肽-1(GLP-1)分泌从而促进胰岛素释放:Theodorakis等把肠和胰岛之间的联系称为肠-胰岛轴,GK被认为是肠道中主要的葡萄糖传感器,类似于它在胰岛细胞中的作用。葡萄糖可以强效刺激肠道K细胞和L细胞分泌葡萄糖依赖性胰岛素释放肽(GIP)和GLP-1,机体通过GIP和GLP-1进一步生理性调节胰岛素分泌。GLP-1与胰岛β细胞膜上的受体结合后,通过G蛋白激活腺苷酸环化酶,使胞内环腺苷酸水平升高,促进胰岛素的合成与释放。
神经细胞-肠道L细胞-胰岛轴
GK参与大脑神经元与胰岛细胞相互协作:在下丘脑中,葡萄糖兴奋神经元中的GK将葡萄糖磷酸化后,导致KATP通道关闭,神经元去极化触发Ca2+通道打开,进而分泌神经递质调节血糖稳态;而在葡萄糖抑制神经元中GK可诱导ATP水平增加,来刺激Na+/K+ ATP泵完成神经元超极化,从而抑制神经元活动。目前的证据表明,大多数葡萄糖兴奋神经元表达厌食性肽,而葡萄糖抑制神经元在低血糖状态下释放刺激食欲的肽来增加摄食。进食引起的胃肠道机械感受器受刺激后产生的饱腹感信号,通过迷走神经传导至脑干,另外一方面,食物刺激肠道GLP-1和GIP的释放进一步影响胰岛素和胰高糖素的释放来维持血糖稳态。GK在垂体前叶细胞中也被证实存在葡萄糖传感功能,但具体机制有待进一步探索。
GK功能受损与2型糖尿病
2型糖尿病(type 2 diabetes mellitus,T2DM)患者普遍存在GK损伤,GK功能显著降低。Del Guerra 等采用T2DM和正常人胰岛离体细胞进行研究后,发现相比正常人群,T2DM患者胰岛细胞数量约减少10%,而GK基因表达约降低40%;葡萄糖刺激的胰岛素分泌量下降了大约50%,且早相胰岛素分泌高峰消失。另一项27在对患肥胖型糖尿病的个体及正常肥胖个体的GK活性研究中,发现患有肥胖型糖尿病的个体肝脏GK活性较正常组下降近50%。
GK的正常功能是稳态系统自主调节的关键,GK功能受损会导致核心调糖靶器官部分能力的缺失,甚至对血糖变化“视而不见”,从而产生胰岛素和胰高糖素分泌失常、葡萄糖利用能力降低、肝糖原合成受阻等糖代谢紊乱,表现为血糖稳态的严重失衡,包括HbA1c不达标、餐后血糖不达标、血糖波动大、低血糖频发等。稳态系统自主调节失常导致血糖失稳态是T2DM发病的基础。
药物研发与用途
葡萄糖激酶激活剂系针对这一靶点而开发,能够通过葡萄糖浓度刺激的胰岛素分泌、降低胰高血糖素浓度和肝糖输出、促进肝糖原合成以及调控肠促胰素释放等机制来稳定体内血糖水平,近年来已成为2 型糖尿病新型药物研发的热点。
自从2001年公开GKA的药理学基础,有关GKA的研究蓬勃发展,迄今为止已经公布了100多项GKA专利,20多种 GKA 药物已经进入临床研究阶段,其中进展最快的是华领医药的Dorzagliatin(HMS5552)(中文曾用名:多扎格列艾汀;中文通用名:多格列艾汀),已进入临床Ⅲ期阶段,预计2021年上市。
“特别声明:以上作品内容(包括在内的视频、图片或音频)为凤凰网旗下自媒体平台“大风号”用户上传并发布,本平台仅提供信息存储空间服务。
Notice: The content above (including the videos, pictures and audios if any) is uploaded and posted by the user of Dafeng Hao, which is a social media platform and merely provides information storage space services.”
为您推荐
算法反馈精品有声
热门文章
精彩视频